Το γεγονός πως το τεστ «αυτοδιάγνωσης» κορονοϊού που διανέμεται δωρεάν από τα φαρμακεία στους μαθητές και τους εκπαιδευτικούς του Λυκείου δημιουργήθηκε ως τεστ για χρήση από επαγγελματίες Υγείας ή υπό την επίβλεψή τους, ωστόσο στην Ελλάδα εγκρίθηκε κατ’ εξαίρεση ως «self» μέσω του Εθνικού Οργανισμού Φαρμάκων, προχώρησε η Roche Diagnostics, μετά από επικοινωνία που είχε το Tvxs.gr με τον αρμόδιο εκπρόσωπό της.
Για αυτό το λόγο, όπως σημείωσε ο εκπρόσωπος της εταιρείας προκύπτει και η επίμαχη διαφοροποίηση που ανέδειξε με ρεπορτάζ το Tvxs.gr στην ελληνική μετάφραση των οδηγιών σε σχέση με τις άλλες γλώσσες, όπου αναφέρεται πως το προϊόν προορίζεται αποκλειστικά για επαγγελματική χρήση σε εργαστήρια ή για αυτοσυλλογή με την επίβλεψη επαγγελματία της υγείας. Να σημειωθεί, ότι η κυβέρνηση εξακολουθεί να μην έχει δώσει απάντηση στα ερωτήματα για δεύτερο 24ωρο, ενώ, η αποκάλυψη του Tvxs.gr έφτασε και στη Βουλή, από τη βουλευτή Κιλκίς του ΣΥΡΙΖΑ, Ειρήνη Αγαθοπούλου.
Ειδικότερα, θέσαμε υπόψην της εταιρείας ότι, ενώ στο φυλλάδιο που συνόδευε τα τεστ αναφέρεται στα ελληνικά πως «το τεστ προορίζεται για αυτοδιάγνωση από τον ίδιο τον ασθενή», ωστόσο, στις άλλες γλώσσες, αλλά και στην επίσημη σελίδα της εταιρείας Roche Diagnostics, στο ίδιο ακριβώς σημείο των οδηγιών, αναφέρεται πως «αυτό το προϊόν προορίζεται για επαγγελματική χρήση σε εργαστηριακά περιβάλλοντα και σε POC (Point Of Care) ή για αυτο-συλλογή υπό την επίβλεψη εργαζομένου στον τομέα της υγείας».
Παραθέτουμε τις οδηγίες στα ελληνικά, καθώς και τις διαφορετικές οδηγίες στα γερμανικά, γαλλικά, αγγλικά και ισπανικά. Το ίδιο αναγράφεται επίσης στα ολλανδικά, τα τουρκικά και σε όλες τις άλλες γλώσσες που περιλαμβάνονται στο φυλλάδιο.
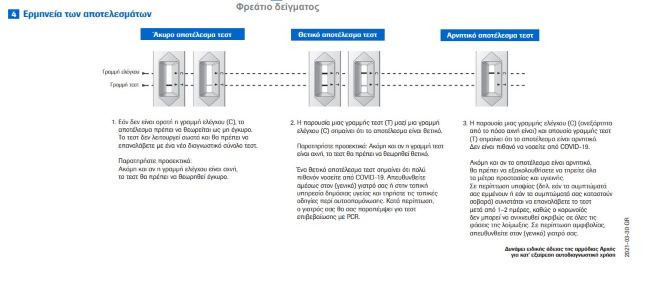
Οι οδηγίες στα ελληνικά:
Οι οδηγίες στα γερμανικά:
Οι οδηγίες στα γαλλικά:
Οι οδηγίες στα ισπανικά:
Οι οδηγίες στα αγγλικά, όπως εμφανίζονται στο site της εταιρείας:
Μάλιστα, αξίζει να σημειωθεί πως σε άλλο σημείο του φυλλαδίου στα Γερμανικά αναφέρεται χαρακτηριστικά: «Nur für In-Vitro Diagnostik. Nicht als Selbsttest geeignet / Προορίζεται για διαγνωση in vitro, δεν προορίζεται για αυτοδιάγνωση». Το ίδιο αναφέρεται και στα γαλλικά στο φύλλο οδηγιών: «Destine uniquement aux diagnostics in vitro.N’ est pas destine a l’ auto-test» / Μετάφραση: «Προορίζεται για διαγνωστικά, για διαγνωση in vitro, Δεν προορίζεται για αυτοδιάγνωση».
Στα γερμανικά:
Στα γαλλικά:
Η απάντηση της εταιρείας
Ο Θανάσης Ακάλεστος, επικεφαλής Ιατρικών και Επιστημονικών Υποθέσεων (Head of Medical Scientific Affairs & Healthcare Development) της Roche Diagnostics Hellas, σε γραπτή απάντησή του τονίζει: «Το ρινικό τεστ ταχείας ανίχνευσης αντιγόνου SARS-CoV-2 είναι μια ποιοτική ανοσοδοκιμασία που στοχεύει στην ανίχνευση του αντιγόνου νουκλεοκαψιδίου του SARS‐CoV‐2 σε άτομα για τα οποία υπάρχει υπόνοια ότι έχουν μολυνθεί με COVID‐19 ή είναι γνωστό ή πιθανολογείται ότι έχουν εκτεθεί στον ιό».
«Το προϊόν έχει ένδειξη CE-IVD για επαγγελματική χρήση σε εργαστήρια και σε περιβάλλον σημείων περίθαλψης ή για χρήση μέσω συλλογής δείγματος από τον ασθενή, υπό τη στενή επίβλεψη ενός εργαζομένου στον τομέα της υγείας. Έχει λάβει όμως ειδική ή κατά παρέκκλιση έγκριση διάθεσης και έναρξης χρήσης ως αυτοδιαγνωστικό στην αγορά από τον ΕΟΦ», ανέφερε, σημειωνοντας ακόμη πως ανάλογη έγκριση έχουν δώσει και άλλες αντίστοιχες αρμόδιες αρχές σε χώρες της Ευρωπαϊκής Ένωσης, όπως στη Γερμανία, Ολλανδία, Τσεχία, Αυστρία , Πορτογαλία και Ελβετία».
Στη συνέχεια, παραπέμπει στον σύντομο οδηγό χρήσης και το εσώκλειστο που διανέμεται στους πολίτες μέσω των φαρμακείων, σημειώνοντας: «Και στα δύο έντυπα υπάρχει disclaimer: “Δυνάμει ειδικής άδειας της αρμόδιας Αρχής για κατ’ εξαίρεση αυτοδιαγνωστική χρήση”.».
Η ανακοίνωση του ΕΟΦ
Την απάντηση της εταιρείας επιβεβαιώνει και ο Εθνικός Οργανισμού Φαρμάκων, ο οποίος, σε σχετική ανακοίνωσή του αναφέρει την «κατά παρέκκλιση έγκριση διάθεσης και έναρξης χρήσης “αυτοδιαγνωστικών προϊόντων ανίχνευσης του κορωνοϊού COVID-19” για επιτακτικούς λόγους προστασίας της δημόσιας υγείας».
Ο Οργανισμός προσθέτει, ότι «προκειμένου περί “αυτοδιαγνωστικών προϊόντων ανίχνευσης του κορωνοϊού COVID-19” (…) ο ΕΟΦ δύναται κατά παρέκκλιση των διατάξεων αυτών, να επιτρέπει προσωρινά, για χρονικό διάστημα που δεν θα υπερβαίνει τους 3 μήνες και για επιτακτικούς λόγους προστασίας της δημόσιας υγείας, ήτοι προς περιορισμό της διασποράς της πανδημίας, τη διάθεση στο εμπόριο και την έναρξη χρήσης τους εντός του εδάφους της Ελληνικής Επικράτειας (…)» υπό προϋποθέσεις.
Αναλυτικά η ανακοίνωση του ΕΟΦ, με ημερομηνία 5/4/2021:
«Ανακοίνωση σχετικά με “αυτοδιαγνωστικά προϊόντα ανίχνευσης του κορωνοϊού COVID19”
Κατά παρέκκλιση έγκριση διάθεσης και έναρξης χρήσης “αυτοδιαγνωστικών προϊόντων ανίχνευσης του κορωνοϊού COVID-19” για επιτακτικούς λόγους προστασίας της δημόσιας υγείας (Σύμφωνα με το αρ. 9 σημείο 12 της Κ.Υ.Α. ΔΥ8Δ/Γ.Π.ΟΙΚ. 3607/892/2001 (ΦΕΚ Β΄ 1060) εναρμόνιση προς τις διατάξεις της Οδηγίας 98/79/ΕΟΚ «για τα in-vitro διαγνωστικά ιατροτεχνολογικά προϊόντα» και σύμφωνα με το Ν.4790/2021 αρ.2).
Ο ΕΟΦ, ως Αρμόδια Αρχή στην Ελλάδα για τα ιατροτεχνολογικά βοηθήματα που χρησιμοποιούνται στη διάγνωση in vitro, δύναται να επιτρέπει, ύστερα από δεόντως αιτιολογημένη αίτηση, τη διάθεση στο εμπόριο και την έναρξη χρήσης εντός του εδάφους της Ελληνικής Επικράτειας, συγκεκριμένων προϊόντων, για τα οποία δεν έχουν εφαρμοστεί οι διαδικασίες που αναφέρονται στις παραγράφους 1 έως 4 του αρ.9 της άνω ΚΥΑ και η χρήση των οποίων γίνεται με σκοπό την προστασία της υγείας.
Προκειμένου περί “αυτοδιαγνωστικών προϊόντων ανίχνευσης του κορωνοϊού COVID-19”, για τα οποία δεν έχουν ολοκληρωθεί ακόμα οι διαδικασίες που αναφέρονται στις παραγράφους 1 έως 4 του αρ.9 της άνω ΚΥΑ, ο ΕΟΦ δύναται κατά παρέκκλιση των διατάξεων αυτών, να επιτρέπει προσωρινά, για χρονικό διάστημα που δεν θα υπερβαίνει τους 3 μήνες και για επιτακτικούς λόγους προστασίας της δημόσιας υγείας, ήτοι προς περιορισμό της διασποράς της πανδημίας, τη διάθεση στο εμπόριο και την έναρξη χρήσης τους εντός του εδάφους της Ελληνικής Επικράτειας, υπό τις ακόλουθες προϋποθέσεις που πρέπει να συντρέχουν σωρευτικά:
α) ο κατασκευαστής να έχει λάβει ειδική ή κατά παρέκκλιση έγκριση διάθεσης και έναρξης χρήσης τους ως αυτοδιαγνωστικών στην αγορά από τον ΕΟΦ σύμφωνα με τα δικαιολογητικά / προδιαγραφές που περιγράφονται παρακάτω, εφόσον ο κατασκευαστής έχει έδρα στην ελληνική επικράτεια ή ο θέτων το προϊόν στην αγορά έχει λάβει τέτοια έγκριση από την αρμόδια Αρχή άλλου κράτους μέλους της ΕΕ, εφόσον το εν λόγω κράτος μέλος έχει θεσπίσει αντίστοιχες προδιαγραφές.
β) οι πληροφορίες στις οδηγίες χρήσεως του προϊόντος να παρέχονται στην Ελληνική γλώσσα με εύληπτο και σαφή τρόπο.
γ) να μην διατίθεται στην ελληνική αγορά αντίστοιχο προϊόν το οποίο να διαθέτει την απαιτούμενη Σήμανση CE ως αυτοδιαγνωστικό ή τα διατιθέμενα ως άνω προϊόντα με τη σήμανση CE να μην επαρκούν για την κάλυψη των αναγκών της ελληνικής αγοράς.
Τα αναγκαία δικαιολογητικά που θα υποβάλλει ο αιτών στον ΕΟΦ σύμφωνα με το Ν.4790/2021
αρ.2, είναι τα εξής:
- Περιγραφή του προϊόντος.
- Ο κατασκευαστής να έχει αποδεδειγμένα υποβάλλει σε Ευρωπαϊκό Κοινοποιημένο Οργανισμό (ΚΟ) αίτηση για την εξέταση του σχεδίου του προϊόντος ως αυτοδιαγνωστικού, σύμφωνα με το Παράρτημα ΙΙΙ, Σημείο 6 της ως άνω ΚΥΑ, και να αναμένεται η έκδοση του πιστοποιητικού CE ελέγχου του σχεδίου. Αν η αίτηση δεν έχει γίνει αποδεκτή από κανένα ΚΟ, αντίγραφο της ενημέρωσης από τον/τους Κοινοποιημένο/ους Οργανισμό/ούς σχετικά με τους λόγους της μη αποδοχής της αίτησης.
- Δήλωση Συμμόρφωσης του Κατασκευαστή ως IVD για επαγγελματική χρήση • Θετική αξιολόγηση του προϊόντος από ειδικό ερευνητικό/ακαδημαϊκό κέντρο για την αξιολόγηση In Vitro Διαγνωστικών προϊόντων στην Ελλάδα ή σε άλλο κράτος μέλος
- Κάλυψη των κριτηρίων επιδόσεων που έχουν καθορισθεί με εισήγηση της Επιτροπής Αντιμετώπισης Συμβάντων Δημόσιας Υγείας από Λοιμογόνους Παράγοντες
- Απόδειξη της αναλυτικής ευαισθησίας και ειδικότητας
- Αποτελέσματα των δοκιμών αξιολόγησης των επιδόσεων
- Μελέτη χρηστικότητας σύμφωνα με το IEC 62366
- Απόδειξη συμμόρφωσης με τις βασικές απαιτήσεις που ορίζονται στο Παράρτημα Ι Σημείο 7 της Οδηγίας 98/79/ΕΚ ειδικά για αυτοδιάγνωση (για χρήση από άτομα τα οποία δεν είναι ειδήμονες)
- Οι πληροφορίες στην ετικέτα και στις οδηγίες χρήσεως του προϊόντος να παρέχονται στην Ελληνική γλώσσα με εύληπτο και σαφή τρόπο, σύμφωνα με την ως άνω ΚΥΑ Παράρτημα Ι – Βασικές Απαιτήσεις – σημείο 8, και να αναγράφουν τον κατασκευαστή, τον εξουσιοδοτημένο αντιπρόσωπο και τον διανομέα του προϊόντος στην Ελλάδα.
- Σε περίπτωση επανασυσκευασίας του προϊόντος θα γίνεται επικόλληση ετικέτας που θα αναγράφει πως πρόκειται για «αυτοδιαγνωστικό βοήθημα» για να χρησιμοποιηθεί κατ’ οίκον από άτομα τα οποία δεν είναι ειδήμονες, τον κατασκευαστή, τον εξουσιοδοτημένο αντιπρόσωπο και τον διανομέα του προϊόντος στην Ελλάδα. Επίσης θα περιλαμβάνονται οι οδηγίες χρήσεως του προϊόντος στην Ελληνική γλώσσα με εύληπτο και σαφή τρόπο. Για τα προϊόντα που διατίθενται σε συσκευασία πολλαπλών δόσεων στα σημεία διάθεσης μαζί με το προϊόν θα χορηγούνται ανά συσκευασία και οι οδηγίες χρήσεως του προϊόντος στην Ελληνική γλώσσα με εύληπτο και σαφή τρόπο, στις οποίες θα αναγράφεται ο κατασκευαστής, ο εξουσιοδοτημένος αντιπρόσωπος και ο διανομέας του προϊόντος στην Ελλάδα.
- Ενημερωμένη ανάλυση επικινδυνότητας, που να αναδεικνύει τους κινδύνους από την χρήση από μη εκπαιδευμένους χρήστες».
Στην Ελλάδα τα ΜΜΕ που στηρίζουν τις νεοφιλελεύθερες πολιτικές, χρημαδοτούνται από το ... κράτος. Tο tvxs.gr στηρίζεται στους αναγνώστες του και αποτελεί μια από τις ελάχιστες ανεξάρτητες φωνές στη χώρα. Mε μια συνδρομή, από 2.9 €/μήνα,ενισχύετε την αυτονομία του tvxs.gr και των δημοσιογραφικών του ερευνών. Συγχρόνως αποκτάτε πρόσβαση στα ντοκιμαντέρ και το περιεχόμενο του 24ores.gr.
Δες τα πακέτα συνδρομών >








![[376455] EUROLEAGUE 2024-2025 / ΟΛΥΜΠΙΑΚΟΣ - ΠΑΝΑΘΗΝΑΙΚΟΣ. (KLODIAN LATO / EUROKINISSI) EUROLEAGUE 2024-2025 / ΟΛΥΜΠΙΑΚΟΣ - ΠΑΝΑΘΗΝΑΙΚΟΣ. (KLODIAN LATO / EUROKINISSI)](https://tvxs.gr/app/uploads/2025/03/6498236.jpg)